Desde Gestlife nos comparten una realidad frecuente: muchas parejas acuden a la clínica tras varios intentos fallidos de fecundación in vitro (FIV), enfrentándose a diagnósticos duros como la imposibilidad de utilizar óvulos propios. Las causas suelen ser claras: edad avanzada, baja calidad ovocitaria o riesgo de transmitir mutaciones genéticas. Hasta hace poco, la única alternativa era recurrir a una donante de óvulos, una decisión que, aunque efectiva, tiene un fuerte impacto emocional para quienes desean mantener el vínculo genético con su futuro hijo.
Hoy, gracias a los avances en biotecnología reproductiva, existe una alternativa revolucionaria: el trasplante pronuclear (PNT) y su variante, el trasplante de huso meiótico (MST). Estas técnicas, conocidas popularmente como parte de la “técnica de los tres padres”, permiten utilizar los óvulos de la madre incluso cuando las mitocondrias (las «baterías» celulares responsables de la energía) están dañadas o envejecidas.
En este artículo, explicaremos en qué consiste esta innovadora técnica, cómo se realiza paso a paso y a quién puede beneficiar. También revisaremos sus aplicaciones en contextos como la gestación subrogada, los resultados clínicos más recientes y las principales limitaciones éticas y técnicas que aún plantea.
¿Tres padres para un solo bebé? No exactamente
Aunque en medios de comunicación se ha popularizado como la “técnica de los tres padres”, esta denominación es técnicamente imprecisa. La terapia de reemplazo mitocondrial (MRT, por sus siglas en inglés) no implica la existencia de tres progenitores genéticos en sentido estricto, sino una combinación muy específica: el bebé hereda el ADN nuclear de sus padres biológicos (es decir, el que determina el color de ojos, los rasgos faciales, la estatura y otros aspectos fenotípicos) y únicamente recibe de la donante un pequeño porcentaje de ADN mitocondrial (mtDNA), que representa menos del 0,001 % del genoma total (Yildirim et al., 2024).
Este mtDNA no codifica características visibles ni influye en la identidad genética principal del bebé, sino que cumple una función bioenergética: garantizar que las mitocondrias, los orgánulos encargados de producir energía celular, funcionen correctamente. Es decir, la donante no aporta herencia genética en el sentido tradicional, sino que actúa como soporte mitocondrial para evitar enfermedades potencialmente graves causadas por fallos en este tipo de ADN (Costa-Borges et al., 2023).
Lejos de crear “hijos con tres padres”, esta técnica representa un avance médico que preserva la herencia genética familiar, al tiempo que protege al futuro bebé de enfermedades mitocondriales hereditarias.
Aplicación en gestación subrogada: una sinergia posible
En clínicas especializadas como Gestlife, la gestación subrogada se plantea como solución en casos donde la madre no puede gestar por razones médicas o por riesgo elevado de transmitir enfermedades mitocondriales. En estos escenarios, la terapia de reemplazo mitocondrial (MRT) ofrece una herramienta poderosa: permite crear un embrión con el ADN nuclear de los padres intencionados y mitocondrias sanas de una donante, que posteriormente se transfiere al útero de la gestante.
Aunque los estudios científicos recientes no analizan directamente la combinación de MRT y gestación subrogada, existe una lógica clínica evidente. La creación de embriones viables, libres de mutaciones mitocondriales y con carga genética propia de los padres, amplía las opciones reproductivas para familias que recurren a la subrogación como último recurso (Hyslop et al., 2025; Subirá et al., 2025).
Además, en casos de infertilidad idiopática o de fallos repetidos en FIV, la MRT mejora la calidad embrionaria antes de la transferencia, lo que puede incrementar la tasa de éxito de una gestación subrogada (Costa-Borges et al., 2023).
En palabras simples: ¿Cómo funciona esta técnica?
Desde Gestlife nos explican que uno de los retos clave en la terapia de reemplazo mitocondrial es su precisión. Para entenderlo con una metáfora sencilla: imagina una célula como una casa. El núcleo sería la biblioteca central, donde se guarda toda la información genética principal (el ADN de los padres). Las mitocondrias, en cambio, son las baterías: no determinan el aspecto del bebé, pero sí proporcionan la energía que mantiene todo en marcha. Si estas baterías están defectuosas, la solución consiste en reemplazarlas sin tocar los planos originales de la casa.
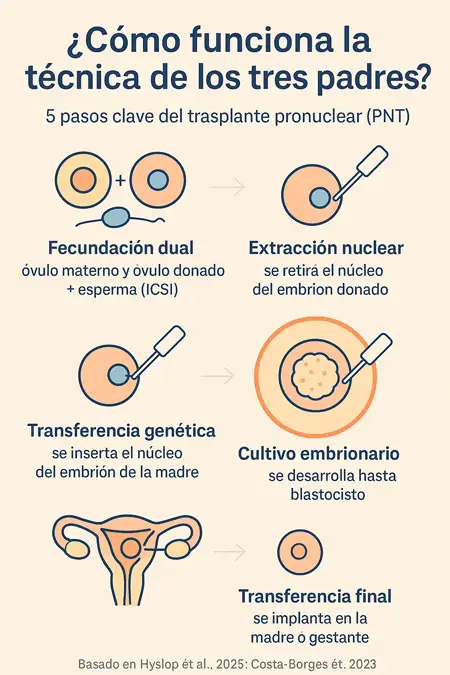
En el caso del trasplante pronuclear (PNT), el procedimiento se realiza de la siguiente manera (Hyslop et al., 2025; Costa-Borges et al., 2023):
- Se fecundan por separado un óvulo de la madre y otro de una donante con el esperma del padre, utilizando la técnica de microinyección intracitoplasmática de esperma (ICSI).
- Del embrión donado se extrae el núcleo, dejando intactas sus mitocondrias funcionales.
- Luego, se transfiere al embrión donado el núcleo del embrión materno (ya fecundado), que contiene el ADN de los padres.
- El embrión resultante (con ADN nuclear parental y mitocondrias sanas) se cultiva hasta la etapa de blastocisto.
- Finalmente, se transfiere al útero de la madre o de la gestante, según el caso.
Todo este proceso exige equipos de laboratorio altamente especializados y personal experto en embriología, debido a la manipulación celular de alta precisión que requiere.
¿A quién puede beneficiar esta técnica?
Desde el enfoque clínico que aplica Gestlife, la terapia de reemplazo mitocondrial está especialmente indicada en estos casos:
- Mujeres portadoras de mutaciones patogénicas en el ADN mitocondrial, que se transmite exclusivamente por vía materna y puede causar enfermedades graves sin tratamiento curativo.
- Pacientes mayores de 40 años, en quienes las mitocondrias envejecidas afectan la calidad de los óvulos y reducen la energía celular disponible para el embrión.
- Mujeres con fallos repetidos de FIV o embriones de mala calidad, especialmente en contextos de infertilidad idiopática.
- Familias que recurren a gestación subrogada y desean evitar la transmisión de mutaciones mitocondriales, asegurando un bebé genéticamente propio y sano.
Como ya vimos, las mitocondrias funcionan como el motor energético de las células, y su correcto funcionamiento resulta fundamental para la viabilidad del embrión. Al reemplazar las defectuosas, esta técnica no solo previene enfermedades, sino que mejora la calidad embrionaria global.
¿Trasplante pronuclear o huso meiótico? Dos caminos, un mismo objetivo
Como hemos visto, Gestlife utiliza principalmente el trasplante pronuclear (PNT) dentro de sus programas especiales. Sin embargo, no es la única técnica disponible dentro de la terapia de reemplazo mitocondrial. Existe otra llamada «trasplante de huso meiótico» (MST), que persigue el mismo fin: evitar la transmisión de mutaciones mitocondriales y asegurar embriones viables, pero mediante un procedimiento distinto.
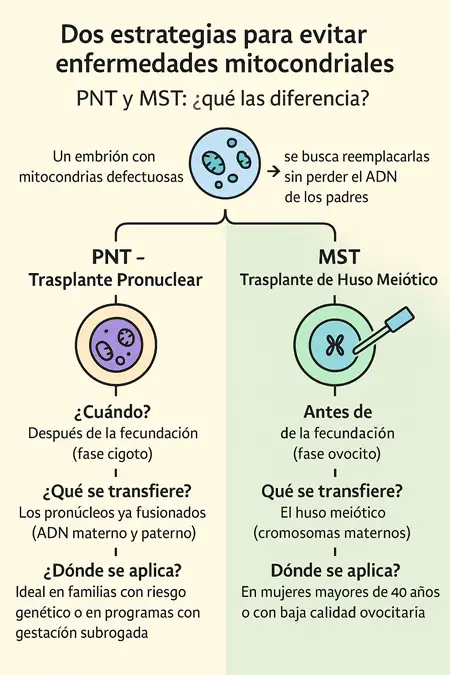
- MST (trasplante de huso meiótico): se realiza antes de la fecundación. Se extrae el huso meiótico (la carga cromosómica del óvulo de la madre) y se transfiere a un óvulo donado previamente enucleado. Después se procede a fecundarlo con el esperma del padre. Es especialmente útil en mujeres con infertilidad idiopática o edad avanzada, ya que mejora la calidad ooplásmica (Costa-Borges et al., 2023; Subirá et al., 2025).
- PNT (trasplante pronuclear): se lleva a cabo después de la fecundación, cuando ya se han formado los pronúcleos (núcleos de esperma y óvulo). Estos pronúcleos se extraen del embrión de los padres y se transfieren a un embrión donado, del cual se han retirado sus propios pronúcleos, preservando así las mitocondrias funcionales.
Ambas estrategias son técnicamente complejas, requieren laboratorios avanzados y embriólogos altamente cualificados, y la elección depende del perfil clínico de la pareja, la causa subyacente de infertilidad y la disponibilidad técnica del centro reproductivo.
Diferencias entre trasplante pronuclear (PNT) y huso meiótico (MST)
| Característica | PNT (trasplante pronuclear) | MST (trasplante de huso meiótico) |
|---|---|---|
| ¿Cuándo se realiza? | Después de la fecundación | Antes de la fecundación |
| ¿Qué se transfiere? | Pronúcleos (óvulo ya fecundado) | Huso meiótico (cromosomas del óvulo) |
| Indicaciones clínicas | Evitar mtDNA defectuoso tras fecundación | Mejorar calidad ovocitaria en mayores de 40 |
| Tipo de manipulación | Embriones en estadio cigoto | Óvulos antes de la fecundación |
| Estudios publicados | Hyslop et al., 2025 | Costa-Borges et al., 2023 |
Resultados clínicos y límites actuales
Los estudios más recientes sobre terapia de reemplazo mitocondrial muestran resultados prometedores. En un grupo de pacientes, se reportaron tasas de fertilización del 92 %, formación de blastocistos del 60 % y nacimientos vivos en un 48 % de los casos, incluso en mujeres mayores de 42 años (Hyslop et al., 2025). Otro piloto de trasplante de huso meiótico en parejas con fallos repetidos de FIV logró 6 nacimientos sanos, con una tasa de embarazo clínico del 37 % por transferencia (Costa-Borges et al., 2023).
Sin embargo, no es una técnica infalible. En algunos casos se detecta un pequeño “carryover” de mitocondrias alteradas (entre 0,8 % y 60 %), existe riesgo de reversión mitocondrial postnatal, y el procedimiento requiere una altísima precisión técnica y equipos especializados (Subirá et al., 2025).
Una nueva puerta para la fertilidad genética
Pese a estos desafíos, el trasplante pronuclear representa una esperanza real y científicamente fundada para quienes pensaban que usar sus propios óvulos era imposible. Gracias a esta técnica, es posible lograr embarazos con carga genética de ambos padres, evitando la transmisión de enfermedades mitocondriales y preservando el vínculo genético familiar.
Referencias consultadas:
- Subirá, J., et al. (2025). Mitochondrial replacement techniques to resolve mitochondrial dysfunction and ooplasmic deficiencies: where are we now? Human Reproduction, 40(4), 585–600. https://doi.org/10.1093/humrep/deaf034
- Yildirim, R. M., et al. (2024). Mitochondria as therapeutic targets in assisted reproduction. Human Reproduction, 39(10), 2147–2159. https://doi.org/10.1093/humrep/deae170
- Costa-Borges, N., et al. (2023). First pilot study of maternal spindle transfer for the treatment of repeated in vitro fertilization failures in couples with idiopathic infertility. Fertility and Sterility, 119(6), 964–973. https://doi.org/10.1016/j.fertnstert.2023.02.008
- Hyslop, L. A., et al. (2025). Mitochondrial donation and preimplantation genetic testing for mtDNA disease. New England Journal of Medicine, 393(5), 438–449. https://doi.org/10.1056/NEJMoa2415539
- Lovell-Badge, R. (2025). Reducing the risks of mitochondrial disease in children. New England Journal of Medicine, 393(5), 500–503. https://doi.org/10.1056/NEJMe2507753