La ciencia y las investigaciones siempre han sido la luz de la esperanza de la humanidad, pero cada día cobran mayor importancia, principalmente en el ámbito sanitario. Las enfermedades que hace décadas parecían invencibles hoy encuentran respuestas en desarrollos que combinan tecnología, biología e innovación clínica. Es en este escenario donde emergen con fuerza las terapias avanzadas en ensayos clínicos, posicionándose como la nueva frontera de la medicina, una frontera que busca no solo tratar, sino curar, aliviar y devolver calidad de vida.
A lo largo de la última década, los ensayos clínicos han dejado de ser meros laboratorios de hipótesis para convertirse en auténticos puentes hacia tratamientos disruptivos. Se ha logrado pasar del concepto a la realidad tangible, especialmente gracias a los llamados medicamentos de terapia avanzada. Estos no son fármacos convencionales; son soluciones vivas, diseñadas con precisión genética, celular o tisular, que actúan sobre la raíz del problema, no sólo sobre los síntomas.
En este artículo veremos qué son exactamente las terapias avanzadas en ensayos clínicos, cómo funcionan, qué tipos existen (desde terapias génicas hasta terapias celulares y regenerativas), sus ventajas clínicas, enfermedades objetivo y, por supuesto, los desafíos técnicos, éticos y regulatorios que plantean. Todo ello enmarcado en el concepto de medicina personalizada, una medicina que no aspira a ser universal, sino única para cada individuo.
¿Qué son las terapias avanzadas? Una revolución médica en marcha
Las terapias avanzadas son medicamentos biotecnológicos definidos en el Reglamento (CE) 1394/2007 como productos medicinales que emplean genes, células o tejidos para tratar enfermedades graves. En términos simples, podríamos decir que, en lugar de administrar una sustancia química como haríamos con una pastilla, aquí introducimos material genético funcional, células vivas modificadas o estructuras creadas en laboratorio que se integran en el cuerpo.
Este enfoque terapéutico incluye tres grandes ramas:
- Terapias génicas: consisten en modificar o reemplazar genes defectuosos.
- Terapias celulares: utilizan células manipuladas para combatir enfermedades o regenerar tejidos.
- Terapias regenerativas: buscan reparar tejidos u órganos dañados mediante ingeniería de tejidos o biomateriales.
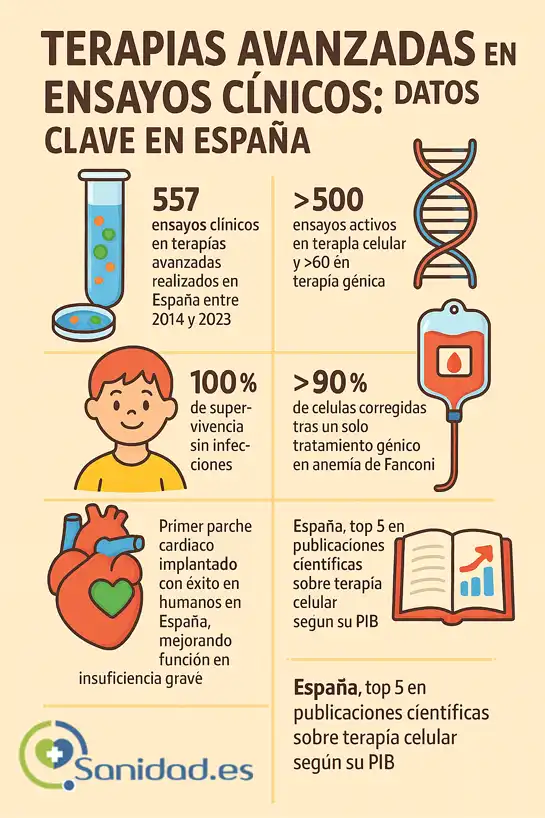
Su impacto va más allá de lo conceptual. En España, se han registrado más de 557 ensayos clínicos en terapias avanzadas entre 2014 y 2023, y actualmente están activos más de 500 centrados en terapia celular y más de 60 en terapia génica (Asociación Española de Bioempresas [AseBio], s.f.).
Clasificación de las terapias avanzadas: génicas, celulares y regenerativas
Como explicaba, las terapias avanzadas se clasifican en tres grandes categorías. Vamos a conocerlas más a fondo:
1. Terapias génicas
Estas terapias corrigen defectos a nivel del ADN. Utilizan vectores virales (como los lentivirus o los virus adenoasociados) para transportar genes funcionales hacia las células del paciente. Pueden administrarse directamente (in vivo) o tras modificar células fuera del cuerpo (ex vivo).
- Ejemplo práctico: en España se ha logrado tratar exitosamente la anemia de Fanconi tipo A mediante la infusión de células madre hematopoyéticas corregidas genéticamente, con resultados publicados en The Lancet en 2024 (Genotipia, 2024). Otro hito español es el tratamiento de la inmunodeficiencia LAD-I, con todos los pacientes tratados vivos y sin infecciones recurrentes tras más de 18 meses (CIBERER, 2025).
Las terapias génicas ofrecen la posibilidad de una sola intervención con efecto duradero, algo que resulta vital en patologías como distrofias musculares, inmunodeficiencias o enfermedades lisosomales.
2. Terapias celulares
Aquí el medicamento es una célula viva, bien del propio paciente (autóloga) o de un donante (alogénica). Las más conocidas son las CAR-T, linfocitos T modificados genéticamente para atacar células tumorales.
España ha sido pionera con proyectos como:
- CAR4SAR, ensayo contra sarcomas pediátricos (Comunidad de Madrid, 2024).
- CARxALL, para leucemia aguda de células T (Fundación Josep Carreras, 2024).
- Ensayo CAR-T académico en mieloma múltiple, liderado por IBSAL (Instituto de Investigación Biomédica de Salamanca, s.f.).
Estas terapias son altamente específicas y, en algunos casos, logran remisiones completas en leucemias refractarias.
3. Terapias regenerativas
Son quizá las más visuales: combinan células con biomateriales y factores de crecimiento para regenerar tejidos dañados. Pensemos en un parche cardíaco creado a partir de células madre que se integra al corazón tras un infarto. Esto ya se ha probado en humanos en España con resultados esperanzadores (Agencia SINC, 2025).
También hay que mencionar el ensayo SPINE, donde se administran células madre mesenquimales alogénicas para tratar lesiones medulares agudas, evaluando seguridad y eficacia (ABC, 2018).
En conjunto, las terapias regenerativas están explorando soluciones para médula espinal, piel, cartílago, hueso e incluso órganos enteros.
¿Cómo funcionan? Mecanismos terapéuticos con precisión quirúrgica
Una de las maravillas de estas terapias es su modo de acción, que difiere radicalmente del enfoque farmacológico clásico. En lugar de bloquear receptores o modular neurotransmisores, se busca corregir, sustituir o reconstruir. ¿Y cómo se logra?
- En la terapia génica, un gen funcional reemplaza uno dañado, corrigiendo la raíz del problema
- En la terapia celular, células inmunitarias son entrenadas para eliminar tumores o regenerar tejidos
- En la terapia regenerativa, se implanta tejido biofabricado que se integra en el órgano lesionado.
Esta aproximación permite alcanzar lo que se llama como medicina personalizada, porque en muchos casos las células o el material genético utilizado proviene del propio paciente, reduciendo al mínimo el rechazo inmunológico.
El papel fundamental de los ensayos clínicos en su desarrollo
Los ensayos clínicos son el alma del progreso biomédico. Sin ellos, ninguna terapia podría pasar de la teoría al tratamiento. Y en el caso de las terapias avanzadas, su papel es aún más crítico.
Debido a su complejidad y riesgo potencial, las terapias avanzadas requieren fases de ensayo rigurosas, a menudo más largas y exigentes que otros medicamentos. En Europa, deben contar con la autorización de la EMA (European Medicines Agency) y seguir protocolos específicos supervisados por la AEMPS en España (AEMPS, 2025).
Pero ojo, estas investigaciones no son simples experimentos; son estudios multicéntricos, regulados, auditados y financiados en gran parte por colaboraciones público-privadas. Instituciones como CIEMAT, CIBERER o el Instituto Josep Carreras están profundamente implicadas.
Gracias a estos ensayos clínicos, se ha logrado que enfermedades sin opciones terapéuticas como la inmunodeficiencia LAD-I o la anemia de Fanconi dispongan hoy de terapias viables con seguimiento clínico probado.
Ventajas frente a tratamientos convencionales: precisión, durabilidad y esperanza

Las terapias avanzadas en ensayos clínicos están marcando un antes y un después en la historia de la medicina contemporánea. Sus beneficios, comparados con los tratamientos tradicionales, no solo son cuantificables en resultados clínicos, sino también en términos de calidad de vida y expectativas para pacientes que antes no tenían opciones reales.
Algunas de sus ventajas más destacadas son:
- Potencial curativo: a diferencia de los tratamientos convencionales que muchas veces solo palian los síntomas, estas terapias buscan actuar sobre la raíz del problema. Por ejemplo, reemplazar un gen defectuoso permite tratar enfermedades genéticas que antes eran incurables (AseBio, s.f.).
- Tratamientos únicos y duraderos: muchas de estas terapias están diseñadas para administrarse una sola vez, generando efectos que pueden durar toda la vida. En el caso de la anemia de Fanconi, un solo trasplante de células corregidas permitió restablecer la producción sanguínea sin necesidad de quimioterapia (Genotipia, 2024).
- Alta especificidad: el uso de células o material genético del propio paciente permite una acción precisa sobre las células enfermas, minimizando los efectos secundarios. Las terapias celulares CAR-T, por ejemplo, eliminan células tumorales sin dañar tejidos sanos, gracias a su receptor quimérico de antígeno específico (Fundación Josep Carreras, 2024).
- Acceso a enfermedades sin tratamiento: muchas nuevas terapias en enfermedades raras y cáncer suponen la única opción para personas que no contaban con alternativas efectivas. Esto es revolucionario en distrofias musculares, enfermedades lisosomales o inmunodeficiencias como LAD-I (CIBERER, 2025).
- Menor agresividad terapéutica: las terapias génicas permiten evitar tratamientos más duros como la quimioterapia o radioterapia. Como señala Julián Sevilla, del Hospital Niño Jesús, modificar células sanguíneas del propio paciente “es mucho menos agresivo que un trasplante de médula” (ABC, 2025).
Enfermedades que abordan hoy: cáncer, raras, neurodegenerativas y más
El abanico de enfermedades en las que están enfocadas estas terapias avanzadas en ensayos clínicos es cada vez más amplio. Pero, se centran especialmente en patologías de alta complejidad o sin alternativas terapéuticas previas. Aquí algunas de las más relevantes desde el punto de vista sanitario:
- Cánceres hematológicos: linfomas, leucemias, mielomas. Las terapias celulares CAR-T han sido muy efectivas aquí, con remisiones completas documentadas en leucemias linfoblásticas refractarias (IBSAL, s.f.).
- Enfermedades genéticas raras: como la anemia de Fanconi, inmunodeficiencias como LAD-I o enfermedades lisosomales. En todos estos casos, las terapias génicas han demostrado eficacia en fases clínicas avanzadas (Genotipia, 2024; CIBERER, 2025).
- Neurológicas y neurodegenerativas: como la atrofia muscular espinal (SMA), con terapias génicas aprobadas como Zolgensma™. También se están evaluando tratamientos para Alzheimer, Parkinson o esclerosis lateral amiotrófica (ELA) mediante vectores virales que cruzan la barrera hematoencefálica (EMA, 2020).
- Cardiovasculares: con enfoques como parches de terapia regenerativa compuestos de cardiomiocitos implantados tras infarto, que han mejorado la función cardíaca en pacientes con insuficiencia severa (Agencia SINC, 2025).
- Lesiones medulares y musculoesqueléticas: mediante células madre mesenquimales para reducir inflamación y promover la regeneración (ABC, 2018). También se investiga la reparación de cartílago y hueso mediante ingeniería tisular.
- Otras patologías: se trabaja en terapias para enfermedades autoinmunes, trasplantes de tejidos y hasta prevención con vacunas de ADN y ARN.
Retos éticos, técnicos y económicos: ¿estamos preparados para esta revolución?
Con toda revolución, vienen también las sombras de la reflexión. Y las terapias avanzadas en ensayos clínicos no son la excepción. Existen numerosos desafíos que deben ser considerados con serenidad y rigor.
Éticos:
- El uso de ingeniería genética genera debates sobre los límites de la intervención humana. Aunque las terapias actuales actúan solo sobre células somáticas (no hereditarias), el fantasma de la edición germinal permanece (EMA, 2020).
- Muchas veces se trata de pacientes pediátricos en situaciones críticas, lo que complica el consentimiento informado y eleva la presión emocional sobre las familias.
- El precio de estas terapias (en algunos casos cercano a los 2 millones de euros por paciente) abre un debate sobre sostenibilidad, equidad y justicia sanitaria (ABC, 2025).
Técnicos:
- Su producción requiere instalaciones GMP, vectores seguros y cultivos celulares complejos
- El proceso es individualizado, lo que dificulta la estandarización y multiplica los costes
- Existe el riesgo de efectos secundarios graves, como el síndrome de liberación de citocinas en CAR-T, que requiere cuidados intensivos específicos.
Regulatorios:
- La EMA exige seguimiento clínico de hasta 15 años para algunas terapias, lo que retrasa su aprobación y encarece los estudios (AEMPS, 2025).
- Las terapias no aprobadas deben evitarse: en 2025, la AEMPS emitió una alerta sobre tratamientos ilegales que pueden poner en riesgo la vida de los pacientes.
A pesar de estas dificultades, los beneficios clínicos observados justifican el esfuerzo. El camino hacia una medicina personalizada más accesible, ética y eficaz depende de cómo gestionemos estos retos con inteligencia colectiva y responsabilidad científica.
Hacia una medicina verdaderamente personalizada
Las terapias avanzadas en ensayos clínicos no son ya una promesa lejana. Son una realidad que ya estamos empezando a presenciar de forma más frecuente, transformando así el tratamiento de enfermedades hasta ahora intratables. Desde la ingeniería genética hasta la biología celular, pasando por la regeneración tisular, estamos ante un cambio de paradigma en cómo entendemos la medicina.
Lo que hace una década era ciencia ficción hoy se traduce en niños con inmunodeficiencia que pueden ir al colegio, pacientes oncológicos que recuperan su vida tras una remisión completa, o personas con enfermedades raras que por fin encuentran una terapia específica.
Con el liderazgo de Europa y España, el respaldo institucional de entidades como la EMA o la AEMPS, y la pasión de investigadores y clínicos comprometidos, el futuro de la medicina personalizada se escribe en presente.
No podemos ignorar los desafíos. Pero si algo nos enseña la historia de la medicina es que, con el esfuerzo colectivo, la regulación adecuada y el compromiso ético, podemos transformar lo imposible en cotidiano.
Referencias consultadas:
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). (s.f.). Terapias avanzadas. Recuperado de https://www.aemps.gob.es/medicamentos-de-uso-humano/medicamentos-de-fabricacion-no-industrial/terapias-avanzadas/
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). (2025). La AEMPS advierte sobre los graves riesgos para la salud de medicamentos de terapia avanzada no autorizados. https://www.aemps.gob.es/informa-en/la-aemps-advierte-sobre-los-graves-riesgos-para-la-salud-de-los-medicamentos-de-terapia-avanzada-no-autorizados
- Asociación Española de Bioempresas (AseBio). (s.f.). Impulsamos la industria de las terapias avanzadas en España. https://www.asebio.com/areas-de-trabajo/salud/terapias-avanzadas
- CIBER de Enfermedades Raras (CIBERER). (2025). Un ensayo clínico de terapia génica para la inmunodeficiencia LAD-I muestra resultados positivos. https://www.ciberer.es/noticias/un-ensayo-clinico-de-terapia-genica-para-la-inmunodeficiencia-lad-i
- Comunidad de Madrid. (2024). La sanidad pública madrileña lidera el primer ensayo clínico en el mundo con una terapia CAR-T alogénica. https://www.comunidad.madrid
- Fundación Josep Carreras contra la Leucemia. (2024). CAR-T para leucemia T. https://fcarreras.org
- Genotipia. (2024). Terapia génica para anemia de Fanconi. https://genotipia.com
- Instituto de Investigación Biomédica de Salamanca (IBSAL). (s.f.). CAR-T académico en mieloma múltiple. https://ibsal.es
- ABC. (2018). Ensayo SPINE para lesión medular. https://www.abc.es
- ABC. (2025). Curar con los propios genes: la revolución silenciosa de la terapia génica. https://www.abc.es
- Agencia SINC. (2025). Parche cardíaco para insuficiencia grave. https://www.agenciasinc.es
- European Medicines Agency (EMA). (2020). Advanced therapy medicinal products: Overview. https://www.ema.europa.eu