Recibir un diagnóstico de VPH puede remover muchas emociones a la vez. Una persona se pregunta si tiene cáncer, si contagiará a su pareja, si podrá tener hijos o si su vida íntima quedará marcada para siempre. En ese torbellino de dudas, una explicación serena y bien fundamentada marca la diferencia.
El primer paso para calmar la inquietud consiste en entender qué es el virus del papiloma humano desde la biología hasta la clínica. Comprender qué hace el virus por dentro y por qué en algunos casos progresa ayuda a tomar decisiones prudentes. También permite valorar riesgos reales y descartar miedos infundados que incrementan la ansiedad y afectan la vida sexual sin motivo.
Nota de salud: Este artículo tiene fines exclusivamente informativos y no sustituye el consejo médico profesional. Ante cualquier duda relacionada con el VPH, su diagnóstico o tratamiento, acude siempre a un profesional sanitario cualificado.
En las próximas líneas te contaré de forma clara, directa y sin rodeos qué es realmente el VPH, por qué hay tipos más peligrosos que otros, cómo actúa en el cuerpo y qué pruebas médicas permiten detectarlo a tiempo. También veremos qué relación tiene con ciertos cánceres, cómo se trata y, sobre todo, cómo se puede prevenir de forma eficaz.
¿Qué es el virus del papiloma humano? Definición rápida y lo esencial
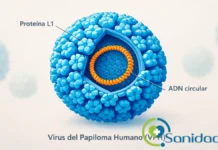
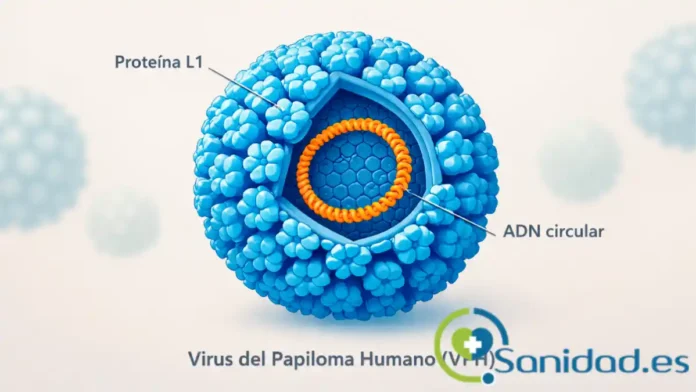
El Virus del Papiloma Humano es el nombre de una familia de más de 230 genotipos de virus de ADN de doble cadena. No se trata de un solo microorganismo, sino de una constelación de tipos con comportamientos distintos y relevancia diversa en salud humana (IARC, 2024). En lenguaje llano, conviene imaginar una “gran familia” con parientes que se parecen pero no se comportan igual: algunos son más problemáticos y otros generan cuadros leves y autolimitados.
Desde el punto de vista biológico, el VPH tiene tres características clave. Primero, no tiene una capa externa grasa, lo que le permite sobrevivir más tiempo fuera del cuerpo en ciertas superficies, a diferencia de otros virus más frágiles. Segundo, su “envoltura” externa (llamada cápside) está formada por una proteína llamada L1, que es la base de las vacunas actuales, y por otra menos abundante llamada L2. Esta cápside actúa como una coraza que protege el material genético del virus. Tercero, su ADN en forma circular contiene instrucciones para fabricar proteínas. Algunas de ellas, como E6 y E7, pueden interferir con los sistemas de defensa de las células humanas, facilitando cambios que, en ciertos casos, podrían favorecer el desarrollo de cáncer (Egawa et al., 2024; National Cancer Institute, 2024).
En la clínica cotidiana, qué es el virus del papiloma humano se resume así: la mayoría de las infecciones se aclaran solas en uno o dos años sin dejar rastro. Un porcentaje menor persiste y, si coincide con ciertos genotipos de alto riesgo y factores del huésped, puede generar lesiones precancerosas. Un grupo reducido progresa hacia cáncer tras varios años si no se detecta y se maneja a tiempo (IARC, 2024; Lechner et al., 2024).
Cómo es el VPH por dentro: cápside, genes y por qué a veces causa cáncer
Comprender la arquitectura interna aclara su comportamiento. La cápside de L1/L2 actúa como una “armadura” dura. Esa dureza le ayuda a soportar ambientes menos favorables, algo muy relevante para su transmisión por contacto con piel y mucosas. El genoma guarda las instrucciones. Entre ellas destacan E6 y E7, que se comportan como “llaves falsas” capaces de desactivar dos guardianes celulares: p53 y pRb. Sin esos guardianes, la célula pierde control del ciclo, acumula errores y se vuelve más vulnerable a transformarse. No significa que cada infección terminará en cáncer. Indica que, en presencia de tipos de alto riesgo y persistencia, el terreno biológico se vuelve más propicio para la progresión (Egawa et al., 2024; National Cancer Institute, 2024).
Hay otro detalle práctico. Cuando el ADN del virus se integra de forma estable en el genoma de la célula huésped, se favorece la expresión sostenida de E6/E7. Este paso es más común con genotipos de alto riesgo y se asocia a lesiones de mayor gravedad. Esa integración no ocurre en todos los casos, aunque representa una bisagra importante en la historia natural de la enfermedad (IARC, 2024).
Tipos de VPH: alto, bajo y “probable” riesgo (y por qué importa la genotipificación)

La infección por el Virus del Papiloma Humano (VPH) no es homogénea: existen muchos tipos de virus con comportamientos distintos y riesgos diversos para la salud. Entender cómo se agrupan según su potencial de causar enfermedad (especialmente cáncer) es clave para interpretar resultados de pruebas, tomar decisiones clínicas informadas y planificar seguimientos personalizados.
– Alto riesgo (hrHPV)
Aquí destacan 16 y 18, responsables juntos de alrededor del 70% de los cánceres de cuello uterino a escala mundial. Además, los tipos 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 y 68 participan en porcentajes menores pero no despreciables. Hay constancia de que 31, 33, 45, 52 y 58 suman alrededor de un 20% adicional de cánceres cervicales. En cáncer orofaríngeo relacionado con VPH, 16 es predominante según revisiones recientes (Lechner et al., 2024; IARC, 2024).
– Bajo riesgo (lrHPV)
Los tipos 6 y 11 causan la mayoría de los condilomas acuminados y también la papilomatosis respiratoria recurrente. Se asocian con lesiones benignas que afectan la calidad de vida pero no avanzan a cáncer en condiciones habituales. En situaciones de inmunosupresión o coinfecciones concurrentes, la dinámica puede acelerarse y merece seguimiento individualizado (Kranick et al., 2024).
– Riesgo intermedio o probable
Genotipos como 53, 73 y 82 han sido discutidos en publicaciones recientes por su potencial oncogénico bajo. Su prevalencia en tumores invasivos es muy inferior a la del grupo 16/18. Las revisiones de criterios para cribado debaten su inclusión para evitar procedimientos innecesarios en personas con lesiones de bajo potencial evolutivo (IARC, 2024; Arbyn et al., 2025).
¿Por qué importa la genotipificación? Porque no todos los VPH se comportan igual. Disponer del número del tipo mejora la estratificación del riesgo y ajusta los intervalos de seguimiento. La evidencia actual respalda que una genotipificación extendida aporta precisión frente a pruebas que informan solo “alto riesgo positivo/negativo” (Arbyn et al., 2025).
Cómo se contagia el VPH y qué tejidos prefiere
El VPH presenta tropismo por epitelios. Prefiere piel y mucosas de la región anogenital y orofaríngea. Para infectar, necesita microabrasiones que le permitan llegar a las células basales. Esas microlesiones ocurren con facilidad durante el contacto íntimo y en actividades cotidianas. El preservativo reduce el riesgo, aunque no lo elimina por completo, ya que se trata de un virus que puede transmitirse por contacto piel con piel en zonas no cubiertas (IARC, 2024; National Cancer Institute, 2024).
Se distinguen tres grandes líneas de infectividad:
- Alfa-papilomavirus: predilección por mucosas genitales y orales; aquí se acumulan los tipos oncogénicos clásicos.
- Beta y gamma-papilomavirus: preferencia cutánea, asociados con verrugas comunes; estudios en población trasplantada exploran su papel en cáncer cutáneo no melanoma, un campo aún en desarrollo (Egawa et al., 2024).
En resumen, qué es el virus del papiloma humano también implica entender dónde le gusta asentarse y cómo entra. La prevención inteligente nace de ese mapa biológico.
Síntomas y señales: de las verrugas a las lesiones precancerosas
Muchas personas con VPH no presentan síntomas visibles. El hallazgo llega por un cribado rutinario o en una revisión por otra causa. Cuando aparecen manifestaciones, suelen incluir:
- Verrugas anogenitales: lesiones blandas, de aspecto verrugoso o en coliflor, causadas a menudo por 6 y 11.
- Cambios citológicos en el cuello uterino detectados por Papanicolaou: desde atipias leves hasta lesiones intraepiteliales de alto grado.
- Lesiones orales: en contextos concretos, con frecuencia subclínicas; el diagnóstico de orofaringe positiva para VPH es patología oncológica y requiere circuitos específicos (Lechner et al., 2024).
La mayoría de las infecciones se aclaran espontáneamente en 12 a 24 meses. La persistencia más allá de ese periodo justifica seguimiento con protocolos establecidos por edad, hallazgos y resultado de pruebas de VPH y citología (IARC, 2024).
Consecuencias en la salud: cánceres asociados y su frecuencia
Cuando hablamos de VPH, es clave diferenciar entre infección y enfermedad. La mayoría de las infecciones son transitorias y no dejan secuelas, pero un pequeño porcentaje (especialmente cuando intervienen genotipos de alto riesgo) puede derivar en cáncer con el paso del tiempo. Entender qué tipos de cáncer están implicados y con qué frecuencia permite dimensionar el riesgo real y reforzar la importancia del cribado y la vacunación.
- Cáncer de cuello uterino: asociación más conocida. El 16 y el 18 lideran la estadística, sumando la mayoría de casos. La progresión desde infección a cáncer invasivo lleva años y ofrece múltiples oportunidades de detección y tratamiento de lesiones precancerosas (IARC, 2024).
- Cáncer orofaríngeo: especialmente amígdala y base de lengua. En países occidentales, el VPH 16 es el actor predominante en tumores VPH-positivos, un patrón reforzado por series actuales (Lechner et al., 2024).
- Cáncer de ano, pene, vulva y vagina: con proporciones variables, siempre con mayor peso de 16 y 18, y contribución de otros genotipos de alto riesgo (IARC, 2024).
Es esencial recordar una idea tranquilizadora. Tener VPH no equivale a tener cáncer. Indica exposición a un virus muy frecuente. La combinación “tipo viral + persistencia + factores del huésped” es la que define el riesgo. Ese riesgo se maneja con cribado, vacunación y decisiones clínicas graduadas (IARC, 2024; National Cancer Institute, 2024).
Pruebas y cribado: Papanicolaou, test de VPH y cuándo hacerlos
El cribado del cuello uterino se apoya en dos pilares. La citología (Papanicolaou) detecta alteraciones celulares. El test de VPH identifica material genético del virus, con sensibilidad alta para lesiones relevantes. Los programas más eficaces combinan o alternan estas herramientas según la edad y la organización sanitaria. Las guías modernas integran secuencias de actuación que evitan intervenciones excesivas en lesiones leves, reservando procedimientos para situaciones con riesgo demostrado (Arbyn et al., 2025; IARC, 2024).
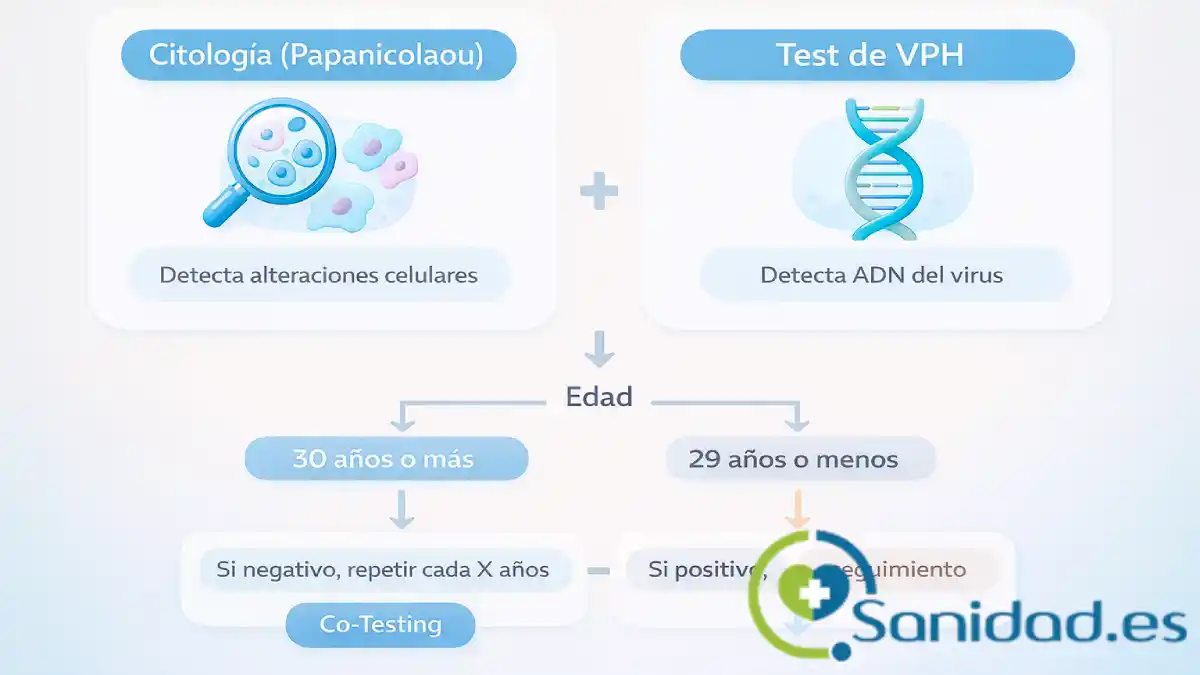
La genotipificación extendida aporta valor cuando se desea afinar el seguimiento. Disponer del resultado “16/18” frente a “otros de alto riesgo” ayuda a priorizar colposcopia o a espaciar controles de manera razonable. Este enfoque evita alarmas innecesarias en personas con tipos menos peligrosos y concentra recursos en quienes más lo necesitan (Arbyn et al., 2025).
Puntos prácticos para recordar:
- El resultado VPH positivo requiere contextualización; no significa lesión grave inmediata.
- Los intervalos de seguimiento se ajustan según edad, citología, tipo viral y antecedentes.
- En varones, el cribado sistemático del VPH genital u orofaríngeo no está estandarizado. Las decisiones se personalizan en función de síntomas, factores de riesgo y disponibilidad de recursos (IARC, 2024).
Tratamientos actuales: verrugas, lesiones de cuello uterino y más
No existe un tratamiento antiviral que “mate” el VPH. La estrategia se centra en tratar las lesiones y acompañar el sistema inmunitario para que la infección se resuelva. En patología anogenital benigna, las opciones incluyen:
- Terapias tópicas: imiquimod, podofilotoxina o ácido tricloroacético en condiciones seleccionadas.
- Procedimientos destructivos: crioterapia, electrocirugía o láser.
- Escisión: cuando la lesión lo requiere o para histología diagnóstica.
En el cuello uterino, el manejo de lesiones intraepiteliales depende de la categoría (bajo o alto grado), de la edad y del deseo reproductivo. Se recurre a exéresis tipo LEEP o conización en alto grado y a vigilancia en lesiones de bajo grado que tienden a revertir. La clave está en preservar salud a largo plazo evitando tratamientos sobrantes que añadan riesgo obstétrico sin beneficio claro (IARC, 2024; Arbyn et al., 2025).
En tumores invasivos relacionados con VPH, los circuitos oncológicos contemplan cirugía, radioterapia y quimioterapia con protocolos específicos. En orofaringe, la identificación del estado VPH-positivo guía decisiones terapéuticas y pronósticas, con perfiles de respuesta y supervivencia característicos (Lechner et al., 2024).
Prevención que funciona: vacuna VPH, preservativo y hábitos saludables
La vacuna VPH ha transformado el panorama. Las formulaciones actuales basadas en L1 (virus-like particles) han demostrado prevenir infecciones persistentes y lesiones precancerosas causadas por los genotipos incluidos. La inmunización en edades tempranas, antes del inicio de la actividad sexual, ofrece el mayor beneficio. La pauta de dosis y la edad objetivo varían según país, aunque el principio es común: vacunar pronto y completar el esquema. En adultos, la vacunación puede valorarse de forma individual cuando el beneficio potencial persiste (National Cancer Institute, 2024; IARC, 2024).
Medidas complementarias:
- Preservativo y pantallas de látex: reducen el riesgo, aunque no lo eliminan por completo.
- Dejar de fumar: el tabaco se asocia con persistencia y progresión de lesiones; abandonar su consumo mejora el pronóstico.
- Cuidado de la salud general: descanso, nutrición equilibrada y control del estrés favorecen la respuesta inmunitaria.
- Información veraz: entender qué es el virus del papiloma humano ayuda a evitar conductas de riesgo por miedo mal gestionado.
Ansiedad y vida sexual: cómo manejar el impacto emocional sin empeorar los riesgos
Las preocupaciones sobre ansiedad y vida sexual aparecen con frecuencia tras conocer un resultado positivo. La información confusa genera distancia en la pareja y deterioro del bienestar. Algunas pautas concretas ayudan:
- Comunicación clara con la pareja: compartir información basada en evidencia reduce sospechas injustificadas. El VPH es común. Atribuirlo a una infidelidad reciente no tiene fundamento científico.
- Acuerdos prácticos: uso de preservativo, completar vacuna VPH si está indicada y asistir a controles.
- Objetivos realistas: la mayor parte de infecciones remiten. Evitar decisiones impulsivas por miedo.
- Acompañamiento profesional: la orientación de profesionales de salud sexual y psicología ofrece herramientas para gestionar la ansiedad y recuperar la intimidad con serenidad (IARC, 2024; National Cancer Institute, 2024).
Comprender el VPH con calma: la clave para proteger salud y bienestar
Saber que uno tiene VPH puede sacudir muchas certezas, pero también puede ser el punto de partida para cuidar mejor de uno mismo. La mayoría de los casos no derivan en complicaciones graves, y hoy contamos con herramientas fiables para detectar, tratar y prevenir. No estás solo ni sola en este proceso. El acompañamiento médico, sin alarmismo ni juicio es tu mejor aliado para tomar decisiones con calma. Recuerda: con información clara y seguimiento adecuado, es posible vivir con tranquilidad y sin miedo.
Referencias consultadas
- Arbyn, M., Xu, L., & Simoens, C. (2025). Accuracy of extended genotyping for HPV screening: A systematic review. The Lancet Oncology, 26(2), 112-125.
- Egawa, N., Doorbar, J., & Griffin, H. (2024). The biology of papillomaviruses. Annual Review of Virology, 11, 201-224.
- International Agency for Research on Cancer (IARC). (2024). Human Papillomaviruses: Classification and Public Health Implications. WHO.
- Kranick, J., Hofer, S., & Müller, M. (2024). Coinfection dynamics of low-risk and high-risk HPV. Journal of Infectious Diseases, 229(4), 1022-1030.
- Lechner, M., Liu, J., & Masterson, L. (2024). HPV-associated oropharyngeal cancer. Nature Reviews Clinical Oncology, 21, 18-32.
- National Cancer Institute. (2024). HPV and Cancer: Molecular Mechanisms. U.S. National Institutes of Health. https://www.cancer.gov